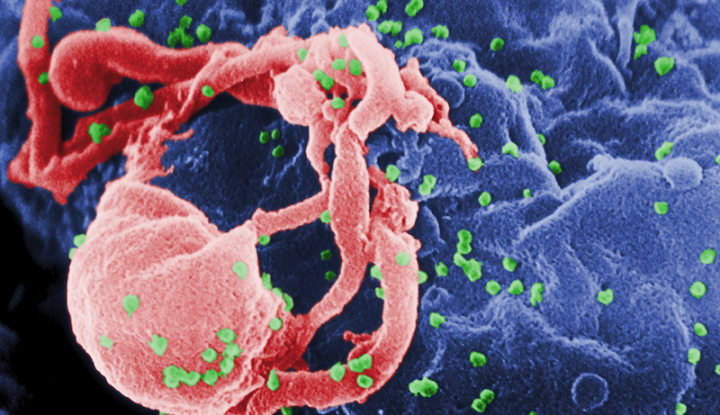
IL VIRUS DELL’IMMUNODEFICIENZA ACQUISITA. CENNI STORICI
 Nel 1981 i Centers for Diseases Control di Atlanta segnalarono il riscontro di alcuni casi di una rara forma di polmonite, la PCP (Polmonite da Pneumocystis carinii), in omosessuali maschi di Los Angeles. Successive osservazioni portarono a stabilire che queste polmoniti interessavano soggetti con immunodepressione, e che si manifestavano prevalentemente in chi aveva avuto trasfusioni di sangue o comportamenti sessuali a rischio. In tal modo venne ipotizzata la presenza di un agente infettivo trasmissibile. Nel luglio 1982, dato l’incremento del numero di questi casi, le Autorità Sanitarie Americane coniarono il termine di AIDS (Acquired ImmunoDeficiency Syndrome) per questa nuova patologia. Nel maggio 1983 il gruppo di Luc Montagnier dell’Istituto Pasteur di Parigi segnalò l’identificazione di un retrovirus che poteva essere il responsabile dell’AIDS; questa scoperta fu confermata nello stesso anno da Robert Gallo del National Cancer Institute di Bethesda, il quale a sua volta fu in grado di isolare lo stesso virus dal sangue di alcuni malati di AIDS. Questo virus venne inizialmente denominato HTLV-III (Human T-Lymphocytotropic Virus tipo 3), data la sua somiglianza con l’HTLV-I, un retrovirus responsabile di alcune forme di leucemia. In seguito si scoprì che il virus aveva delle caratteristiche biologiche diverse da quelle dei retrovirus noti fino a quel momento, per cui venne chiamato con il nuovo termine di HIV (Human Immunodeficiency Virus). Nel marzo 1985 la FDA (Food and Drug Administration) approvò il primo test per la determinazione degli anticorpi contro il virus HIV, che venne immediatamente introdotto tra gli esami eseguiti per la sorveglianza di routine dei donatori di sangue. Due anni dopo, nel marzo 1987, venne registrato negli Stati Uniti il primo farmaco attivo contro l’HIV, la Zidovudina (AZT). Nel 1991, dopo un decennio dall’inizio dell’epidemia, l’OMS (Organizzazione Mondiale della Sanità) rese noto che circa 10 milioni di persone in tutto il mondo avevano contratto l’infezione, e che circa la metà di queste erano già decedute per AIDS. Nel 1992 furono effettuati i primi studi finalizzati a dimostrare l’efficacia di una terapia con due farmaci, mentre nel dicembre 1995 la FDA approvò il Saquinavir, il primo di una nuova e promettente classe di farmaci, gli inibitori delle proteasi. Nel luglio 1996, in occasione della XI Conferenza Internazionale sull’AIDS tenutasi a Vancouver (Canada) sono stati riportati i successi dei nuovi regimi di terapia combinata con almeno tre farmaci, in grado di azzerare la replicazione virale nel sangue nella maggior parte dei soggetti trattati, arrestando così l’evoluzione dell’infezione. L’OMS ha stimato. L’entusiasmo provocato nei Paesi Occidentali dai successi dei nuovi regimi terapeutici si scontra con la realtà epidemiologica dell’infezione: infatti la grande maggioranza delle persone HIV positive, circa l’85-90%, è concentrata nei Paesi in via di sviluppo e principalmente nell’Africa sub-Sahariana, Paesi che non possono permettersi l’elevato costo dei farmaci indispensabili per la terapia. L’ultima Conferenza Internazionale sull’AIDS, tenutasi a Ginevra nel giugno scorso, il cui motto era Bridging the Gap, ha sottolineato questi aspetti.
Nel 1981 i Centers for Diseases Control di Atlanta segnalarono il riscontro di alcuni casi di una rara forma di polmonite, la PCP (Polmonite da Pneumocystis carinii), in omosessuali maschi di Los Angeles. Successive osservazioni portarono a stabilire che queste polmoniti interessavano soggetti con immunodepressione, e che si manifestavano prevalentemente in chi aveva avuto trasfusioni di sangue o comportamenti sessuali a rischio. In tal modo venne ipotizzata la presenza di un agente infettivo trasmissibile. Nel luglio 1982, dato l’incremento del numero di questi casi, le Autorità Sanitarie Americane coniarono il termine di AIDS (Acquired ImmunoDeficiency Syndrome) per questa nuova patologia. Nel maggio 1983 il gruppo di Luc Montagnier dell’Istituto Pasteur di Parigi segnalò l’identificazione di un retrovirus che poteva essere il responsabile dell’AIDS; questa scoperta fu confermata nello stesso anno da Robert Gallo del National Cancer Institute di Bethesda, il quale a sua volta fu in grado di isolare lo stesso virus dal sangue di alcuni malati di AIDS. Questo virus venne inizialmente denominato HTLV-III (Human T-Lymphocytotropic Virus tipo 3), data la sua somiglianza con l’HTLV-I, un retrovirus responsabile di alcune forme di leucemia. In seguito si scoprì che il virus aveva delle caratteristiche biologiche diverse da quelle dei retrovirus noti fino a quel momento, per cui venne chiamato con il nuovo termine di HIV (Human Immunodeficiency Virus). Nel marzo 1985 la FDA (Food and Drug Administration) approvò il primo test per la determinazione degli anticorpi contro il virus HIV, che venne immediatamente introdotto tra gli esami eseguiti per la sorveglianza di routine dei donatori di sangue. Due anni dopo, nel marzo 1987, venne registrato negli Stati Uniti il primo farmaco attivo contro l’HIV, la Zidovudina (AZT). Nel 1991, dopo un decennio dall’inizio dell’epidemia, l’OMS (Organizzazione Mondiale della Sanità) rese noto che circa 10 milioni di persone in tutto il mondo avevano contratto l’infezione, e che circa la metà di queste erano già decedute per AIDS. Nel 1992 furono effettuati i primi studi finalizzati a dimostrare l’efficacia di una terapia con due farmaci, mentre nel dicembre 1995 la FDA approvò il Saquinavir, il primo di una nuova e promettente classe di farmaci, gli inibitori delle proteasi. Nel luglio 1996, in occasione della XI Conferenza Internazionale sull’AIDS tenutasi a Vancouver (Canada) sono stati riportati i successi dei nuovi regimi di terapia combinata con almeno tre farmaci, in grado di azzerare la replicazione virale nel sangue nella maggior parte dei soggetti trattati, arrestando così l’evoluzione dell’infezione. L’OMS ha stimato. L’entusiasmo provocato nei Paesi Occidentali dai successi dei nuovi regimi terapeutici si scontra con la realtà epidemiologica dell’infezione: infatti la grande maggioranza delle persone HIV positive, circa l’85-90%, è concentrata nei Paesi in via di sviluppo e principalmente nell’Africa sub-Sahariana, Paesi che non possono permettersi l’elevato costo dei farmaci indispensabili per la terapia. L’ultima Conferenza Internazionale sull’AIDS, tenutasi a Ginevra nel giugno scorso, il cui motto era Bridging the Gap, ha sottolineato questi aspetti.
VIROLOGIA
 Le origini dell’HIV La teoria che ha trovato maggiori consensi circa l’origine dell’HIV sostiene che questo virus sia derivato da mutazioni di un virus che colpisce alcuni scimpanzé africani, il SIV (Scimmian Immunodeficiency Virus). Questo virus sarebbe migrato dal serbatoio dei primati a quello umano probabilmente con la cacciagione oppure tramite riti tribali che comportavano il contatto con il sangue di questi animali. Il SIV sarebbe poi mutato nell’HIV nel corso di molti anni. Tale ipotesi è stata successivamente confermata dal lavoro di un gruppo di ricercatori della University of Alabama di Birmingham, presentata alla VI Conferenza sui Retrovirus e sulle Infezioni Opportunistiche, tenutasi a Chicago all’inizio di febbraio 1999. L’HIV sarebbe quindi verosimilmente esistito per lungo tempo in piccole comunità tribali dell’Africa. L’urbanizzazione, soprattutto durante il colonialismo, ha portato a grandi spostamenti di persone e all’acquisizione di costumi più liberi, con conseguente aumento degli scambi sessuali, dovuti anche alla prostituzione. Questi movimenti hanno favorito la diffusione dell’HIV, creando così una “base” di individui infetti, sufficiente alla futura espansione dell’infezione. In seguito, vari fattori quali i contatti con l’Occidente, l’uso di siringhe ipodermiche non sterili per le campagne di vaccinazione, l’impiego di emotrasfusioni nei casi di malaria, hanno favorito la diffusione dell’HIV. Nell’Occidente, libertà sessuale e tossicodipendenza hanno poi originato l’epidemia che abbiamo conosciuto negli anni ’80 e ’90. Un articolo pubblicato sulla rivista Nature dal gruppo di David Ho (direttore del Aaron Diamond AIDS Research Center di New York), ha riportato la scoperta di tracce del genoma dell’HIV in un campione di sangue del 1959, appartenente ad un uomo vissuto a Kinshasa (Congo). Se confermato, questo dato sarebbe la testimonianza del primo caso di infezione da HIV accertato, dimostrando quindi la circolazione del virus da circa 40 anni.
Le origini dell’HIV La teoria che ha trovato maggiori consensi circa l’origine dell’HIV sostiene che questo virus sia derivato da mutazioni di un virus che colpisce alcuni scimpanzé africani, il SIV (Scimmian Immunodeficiency Virus). Questo virus sarebbe migrato dal serbatoio dei primati a quello umano probabilmente con la cacciagione oppure tramite riti tribali che comportavano il contatto con il sangue di questi animali. Il SIV sarebbe poi mutato nell’HIV nel corso di molti anni. Tale ipotesi è stata successivamente confermata dal lavoro di un gruppo di ricercatori della University of Alabama di Birmingham, presentata alla VI Conferenza sui Retrovirus e sulle Infezioni Opportunistiche, tenutasi a Chicago all’inizio di febbraio 1999. L’HIV sarebbe quindi verosimilmente esistito per lungo tempo in piccole comunità tribali dell’Africa. L’urbanizzazione, soprattutto durante il colonialismo, ha portato a grandi spostamenti di persone e all’acquisizione di costumi più liberi, con conseguente aumento degli scambi sessuali, dovuti anche alla prostituzione. Questi movimenti hanno favorito la diffusione dell’HIV, creando così una “base” di individui infetti, sufficiente alla futura espansione dell’infezione. In seguito, vari fattori quali i contatti con l’Occidente, l’uso di siringhe ipodermiche non sterili per le campagne di vaccinazione, l’impiego di emotrasfusioni nei casi di malaria, hanno favorito la diffusione dell’HIV. Nell’Occidente, libertà sessuale e tossicodipendenza hanno poi originato l’epidemia che abbiamo conosciuto negli anni ’80 e ’90. Un articolo pubblicato sulla rivista Nature dal gruppo di David Ho (direttore del Aaron Diamond AIDS Research Center di New York), ha riportato la scoperta di tracce del genoma dell’HIV in un campione di sangue del 1959, appartenente ad un uomo vissuto a Kinshasa (Congo). Se confermato, questo dato sarebbe la testimonianza del primo caso di infezione da HIV accertato, dimostrando quindi la circolazione del virus da circa 40 anni.
CARATTERISTICHE L’HIV
è un virus con genoma ad RNA appartenente alla famiglia dei Retrovirus, genere Lentivirus. Attualmente se ne conoscono due tipi: HIV-1, diffuso in tutto il mondo (quello che abitualmente conosciamo) e HIV-2, presente solo in alcuni Paesi africani e meno virulento del tipo 1. Il virus è composto da una parte centrale, il core, e da un involucro fosfolipidico esterno di rivestimento, l’envelope. Nell’envelope sono presenti due glicoproteine denominate gp120 e gp41, importanti per i meccanismi che permettono al virus di legarsi alle cellule bersaglio. All’interno del core si trovano invece l’RNA genomico, proteine del nucleocapside (p24 e p15) ed enzimi fondamentali per i processi di replicazione virale, quali la transcriptasi inversa (p51), l’integrasi (p32) e la proteasi (p11). L’RNA contiene tre geni principali che codificano la sintesi di importanti componenti strutturali e funzionali del virus:
- env: codifica la produzione della glicoproteina gp160, la quale poi si scinde a formare la glicoproteina di superficie gp120 e la glicoproteina transmembrana gp41, entrambi costituenti dell’envelope;
- pol: codifica la sintesi degli enzimi transcriptasi inversa, integrasi e proteasi;
- gag: codifica la sintesi della proteina nucleocapsidica p24. Sono poi presenti altri geni (tat, nef, rev, ecc.) che sono responsabili della regolazioni delle diverse fasi del ciclo vitale del virus.
REPLICAZIONE L’HIV
Come tutti i retrovirus, è incapace di replicarsi al di fuori di una cellula; il ciclo replicativo del virus viene solitamente suddiviso in varie fasi:
- adesione: per poter penetrare nella cellula bersaglio l’HIV deve prima di tutto legarsi ad essa; il virus si può legare a cellule che abbiano sulla loro superficie uno specifico recettore, denominato CD4, al quale aderisce tramite la glicoproteina di superficie gp120. Recentemente sono stati identificati anche dei co-recettori necessari al virus per penetrare nella cellula bersaglio; il principale di questi co-recettori è stato denominato CCR5. Si è visto che persone affette da una difetto genetico di questo corecettore sono in grado di resistere all’infezione.
- uncoating: una volta penetrato nella cellula, il virus perde il proprio rivestimento esterno (l’envelope) in un processo chiamato uncoating (svestimento); in questo modo si libera la parte centrale del virus che contiene il genoma. Può così avere inizio il processo di replicazione vera e propria.
- trascrizione: nel citoplasma della cellula ha luogo questa fase durante la quale uno specifico enzima dell’HIV, la transcriptasi inversa, costruisce una molecola di DNA a doppia catena esattamente identica all’RNA originale del virus; il DNA così formato prende il nome di provirus. Questo processo avviene nelle prime ore successive all’infezione della cellula.
- integrazione: il Provirus viene quindi trasportato nel nucleo della cellula. In questa sede, grazie all’intervento di un altro enzima virale, l’integrasi, viene inserito nel genoma cellulare, dove rimane per tutta la vita della cellula stessa. A questo punto l’HIV sotto forma di provirus può rimanere in fase di latenza anche per lunghi periodi di tempo, duplicandosi solo con la replicazione della cellula stessa. Ad un certo momento però il virus può attivarsi: in questo caso il DNA virale “ordina” alla cellula la produzione di propri componenti, quali le proteine strutturali, gli enzimi e l’RNA genomico.
- assemblaggio: i componenti virali neoprodotti vengono trasportati alla periferia della cellula, dove vengono assemblati tra loro dando origine ad una nuova particella virale (virione). Le particelle virali così formatesi possono poi fuoriuscire dalla cellula per gemmazione, oppure essere liberate all’esterno in seguito alla morte della cellula.
- maturazione: i virioni appena usciti sono ancora immaturi, cioè incapaci di infettare altre cellule. Interviene in questa fase un importante enzima virale, la proteasi, che permette la trasformazione della particella virale nella forma matura. Solo a questo punto la nuova particella di HIV è in grado di propagare l’infezione ad altre cellule.
PATOGENESI – MECCANISMO DI INFEZIONE
Le probabilità che dopo l’ingresso del virus nell’organismo l’infezione si instauri effettivamente dipende principalmente da due fattori: la carica infettante, cioè il numero di particelle virali penetrate (più la carica virale è alta maggiore è il rischio di infezione), ed il numero di cellule recettive (cioè suscettibili di essere infettate) presenti nella sede di ingresso del virus. Come detto in precedenza, l’HIV è in grado di infettare le cellule che presentano sulla loro superficie il recettore CD4; molti tipi di cellule dell’organismo umano possiedono questo recettore, tuttavia il bersaglio principale del virus e’ rappresentato dal linfocita T Helper (o linfocita CD4+). E’ stato inoltre dimostrato che l’HIV, per poter penetrare in una cellula, oltre al recettore CD4 necessita anche della presenza di altre strutture sulla superficie cellulare, denominate corecettori, il principale dei quali è denominato CCR5. questi sono dei recettori per delle sostanze denominate chemochine, normalmente prodotte da alcune cellule del sistema immunitario. Alcuni studi recenti hanno dimostrato che persone con un difetto genetico omozigote (completo) per il quale non viene prodotto il recettore CCR5 sono resistenti all’infezione, e che persone con un difetto eterozigote (parziale) possono essere infettate dall’HIV ma hanno una progressione molto lenta dell’infezione. Il linfocita CD4 costituisce il cardine principale di tutto il sistema immunitario, essendo in grado di regolare, come un direttore d’orchestra, l’attività di tutte le altre cellule responsabili della difesa immunitaria dell’organismo. Altre cellule che possono essere infettate dal virus sono i monociti, un tipo di globuli bianchi, ed i macrofagi, cellule di difesa presenti nei tessuti. Una volta che l’infezione si è stabilita, il virus entra nel torrente circolatorio e dalla sede di ingresso si diffonde a tutto l’organismo, localizzandosi principalmente negli organi e nei tessuti maggiormente popolati da cellule recettive, quali linfonodi, milza, fegato e midollo osseo (organi del sistema emo-linfopoietico). In queste sedi il virus e’ in grado di stabilirsi e di rimanervi a lungo in fase di latenza, oppure di replicarsi in modo continuo; i linfonodi in particolare rappresentano una delle principali sedi di replicazione dell’HIV durante la fase di latenza clinica.
Nel corso dell’infezione si stabiliscono quindi due diversi “compartimenti virologici” , tra i quali vi è però una comunicazione continua:
- compartimento attivo, costituito dal virus libero nel sangue e da quello contenuto nei linfociti e monociti, dove il virus è attivamente replicativo ed è in grado di provocare danno al sistema immunitario;
- compartimento di latenza (reservoirs), costituito da virus che non si replica attivamente, ma che resta in fase latente in alcuni distretti dell’organismo.
Questi compartimenti di riserva sono principalmente rappresentati da alcuni organi, quali cervello e gonadi (dove ci sono barriere anatomiche che impediscono la libera circolazione delle cellule e dei farmaci, permettendo così la creazione di condizioni particolarmente favorevoli per la persistenza del virus), e da alcuni compartimenti cellulari:
- le cellule follicolari dendritiche dei linfonodi (FDC), che sono in grado di trattenere sulla loro superficie esterna particelle virali che si possono mantenere infettive per lungo tempo. Queste cellule hanno comunque una emivita di circa due settimane, e quindi abbastanza breve (12 r).
- i macrofagi infettati, i quali non vengono uccisi dal virus, il quale può pertanto continuare a replicarsi. L’emivita dei macrofagi in soggetti non infetti è di circa 15 giorni.
- i T linfociti CD4+ di memoria, che costituiscono probabilmente il più importante dei compartimenti cellulari di riserva. In queste cellule latenti il virus non è in grado di replicarsi, ma resta sempre presente con una copia del proprio genoma integrato nel DNA della cellula. I linfociti CD4+ di memoria hanno una vita molto lunga, dato che la loro funzione biologica è proprio quella di garantire all’organismo una protezione immunitaria nei confronti di antigeni incontrati in precedenza; queste cellule, quando nel corso della loro vita incontrano l’antigene per il quale sono “programmate”, ritornano alla fase attiva, durante la quale possono permettere al virus di replicarsi. In seguito, dopo diversi cicli di replicazione, molte di queste cellule andranno incontro a morte, mentre altre ritorneranno alla fase di latenza, contribuendo così al mantenimento di una stabile riserva virale. Questo serbatoio virale sarebbe quindi il principale responsabile della persistenza dell’infezione anche in corso di una efficace terapia antiretrovirale, rappresentando in questo modo il più importante ostacolo alla eradicazione dell’infezione.
TRASMISSIONE L’HIV
E’ stato isolato in tutti i tessuti e liquidi biologici di un soggetto sieropositivo. Tuttavia la semplice presenza del virus in un materiale biologico non significa che il contatto con quello stesso materiale rappresenti un evento efficace per la trasmissione dell’infezione. Perchè ciò avvenga è infatti importante che si verifichino due condizioni:
- una idonea via di trasmissione
- una adeguata quantità di virus
Una quantità di virus (carica virale) sufficiente a trasmettere l’infezione si può ritrovare solo in determinati liquidi biologici, quali sangue, liquido seminale, secreto vaginale e, in percentuale inferiore, nel latte materno. Altri materiali sono considerati a rischio solo se contaminati da sangue, in quanto la concentrazione di HIV è troppo bassa perchè la trasmissione possa avvenire.
Un soggetto che ha contratto l’infezione in un modo, per esempio tramite contatto con sangue infetto, può trasmetterla per altra via, per esempio mediante un rapporto sessuale.
Trasmissione sessuale
La trasmissione sessuale dell’HIV rappresenta la modalità di contagio prevalente nel mondo, ed è il fattore maggiormente responsabile della rapida espansione dell’epidemia in Paesi asiatici quali l’India e la Thailandia. La trasmissione può avvenire per contatto sia omosessuale che eterosessuale, ed in quest’ultimo caso è più frequente da uomo a donna che non da donna a uomo. E’ comunque difficile stabilire con certezza la percentuale di rischio di contagio in seguito ad un rapporto sessuale; infatti ci sono persone che si sono contagiate dopo un singolo rapporto, mentre altre non hanno contratto l’infezione anche dopo anni di rapporti con un partner sieropositivo. Ci sono infatti molti fattori che influenzano la possibilità che si verifichi effettivamente la trasmissione del virus:
- fattori comportamentali (numero di partners diversi, rapporti con persone ad alto rischio p.e. prostitute e/o tossicodipendenti, utilizzo del profilattico, tipo di rapporto)
- condizioni psichiche (l’utilizzo di droghe o alcolici può infatti compromettere la capacità di giudizio, e quindi la consapevolezza di utilizzare adeguati strumenti di prevenzione in caso di rapporti a rischio)
- concomitante presenza di malattie sessualmente trasmesse (la presenza di altre malattie che interessano gli organi genitali, quali per esempio Condilomi, Herpes, lesioni ulcerative, ecc., favoriscono la trasmissione dell’HIV, per diversi motivi le lesioni sulla cute e sulle mucose costituiscono una comoda porta d’ingresso per il virus)
- nelle zone infiammate c’è una elevata concentrazione di cellule bersaglio del virus, quali linfociti, monociti e macrofagi, per cui il virus trova subito un terreno ideale per la sua moltiplicazione
- i soggetti sieropositivi sono maggiormente infettanti, in quanto nelle loro secrezioni sono presenti un maggior numero di particelle virali.
Fattori legati al singolo individuo:
- Infettività: non tutti i soggetti sieropositivi sono infettanti allo stesso modo; la possibilità di trasmettere l’infezione infatti dipende anche dallo stadio dell’infezione e dalla quantità di virus presente nel sangue e nelle secrezioni. In particolare la carica virale e’ solitamente più elevata nel periodo immediatamente successivo al contagio e nelle fasi più avanzate della malattia. L’infettività può inoltre variare in relazione alla terapia antiretrovirale.
- Resistenza all’infezione: per particolari caratteristiche genetiche e immunologiche alcuni individui sono particolarmente resistenti all’infezione, per cui non si contagiano anche se vengono esposti al virus (ciò è stato osservato per individui che possiedono variazioni genetiche di particolari corecettori necessari all’HIV per poter infettare le cellule).
Fattori legati al virus:
- Carica virale: come detto prima, dipende essenzialmente dallo stadio dell’infezione e dalla terapia.
- Genotipo virale: sono noti 17 genotipi diversi di HIV, e vari studi hanno dimostrato che alcuni di questi hanno una più elevata trasmissibilità per via sessuale, come per esempio il genotipo E, particolarmente diffuso in Thailandia. NB: Questi fattori però non possono essere conosciuti a priori, per cui bisogna sempre considerare che può bastare anche un solo rapporto per contrarre l’infezione.
Trasmissione con il sangue L’HIV può essere trasmesso tramite trasfusione di sangue infetto o di emocomponenti preparati con sangue di una persona infetta. Infezioni secondarie ad emotrasfusioni erano descritte soprattutto prima del 1985, anno in cui si e’ reso disponibile il test per lo screening dei donatori. In seguito le segnalazioni di infezioni secondarie a trasfusione di sangue sono divenute sempre più rare; a ciò hanno contribuito diversi fattori, quali lo screening dei donatori, la ripetizione del test su tutte le unità di sangue prelevate, l’abolizione dei donatori professionali e l’educazione sanitaria dei donatori, in modo che questi evitino volontariamente la donazione se hanno avuto dei comportamenti a rischio. Recentemente (luglio 1999) in Australia e’ stato riportato un caso di infezione da HIV avvenuto tramite emotrasfusione, il primo dal 1985; il sangue proveniva da una donatrice che aveva donato il sangue durante il periodo finestra.
Trasmissione parenterale
La via parenterale e’ il modo più facile che ha il virus per poter essere trasmesso da un individuo all’altro; l’efficienza della trasmissione parenterale può infatti arrivare fino al 90%. Ciò è dovuto al fatto che il virus, arrivando direttamente nel torrente circolatorio, trova subito moltissime cellule bersaglio, rappresentate essenzialmente dalle cellule mononucleate (linfociti e monociti). Il fattore di rischio principale per la trasmissione parenterale dell’HIV è rappresentato senza dubbio dalla tossicodipendenza. Questa modalità di contagio è quella prevalente in Italia e in tutta l’Europa Occidentale . In Italia, soprattutto nelle grandi città del Nord, sono state descritte percentuali di sieropositività tra i tossicodipendenti di oltre il 60%. La trasmissione del virus tra i tossicodipendenti avviene principalmente tramite la contaminazione con sangue infetto di aghi e altri oggetti utilizzati per la preparazione della droga, i quali vengono spesso riutilizzati più volte e scambiati tra persone diverse. Uno studio condotto nel 1992, basato sull’impiego di un modello matematico costruito analizzando la presenza di HIV nel sangue residuo di siringhe utilizzate da tossicodipendenti sieropositivi, ha stimato in 1 ogni 150 iniezioni il rischio di contagio. Anche altre pratiche, come i tatuaggi ed il body piercing, sono a rischio per la trasmissione dell’HIV; infatti tali manovre vengono spesso eseguite da personale inesperto che ignora le corrette procedure di sterilizzazione degli aghi. Qualsiasi oggetto che superi l’integrità della barriera cutanea può essere infatti in grado di trasmettere infezioni quali l’HIV ed i virus dell’epatite, per cui tutti questi oggetti devono sempre essere adeguatamente sterilizzati.
Esposizione accidentale L’HIV è un virus poco resistente all’ambiente esterno, anche se in condizioni favorevoli può sopravvivere anche per due o tre giorni. L’essiccamento provoca una riduzione della carica virale di oltre il 90% in poche ore. In caso di ferita accidentale con materiale contaminato, perchè avvenga effettivamente il contagio sono importanti vari fattori:
- Carica virale nel sangue residuo;
- Tipo di strumento con il quale avviene la contaminazione (per esempio una puntura con un ago cavo è più pericolosa della lesione con un ago pieno, in quanto il residuo di sangue e’ maggiore nel primo caso);
- Durata del contatto e profondità della lesione;
- Lesioni preesistenti dell’operatore e suo stato immunitario.
Complessivamente, dopo una esposizione accidentale con sangue contaminato il rischio di contrarre l’infezione e’ di circa lo 0,2-0,3%
Trasmissione verticale L’HIV può essere trasmesso da madre al figlio. Questo può avvenire essenzialmente tramite tre modalità:
- durante la gravidanza attraverso la placenta (20-40%)
- durante il parto (40-70%)
- tramite l’allattamento (10-20%)
Per ridurre il rischio di infezione del neonato alle donne sieropositive viene solitamente praticato il parto cesareo e viene consigliato di non allattare. Complessivamente il rischio che il neonato resti contagiato è di circa il 15-25%, ma questa percentuale è stata notevolmente ridotta (fino a meno del 5%) con l’utilizzo di profilassi farmacologica durante la gravidanza e dopo il parto. Il rischio di trasmissione dell’infezione varia poi in base ad altri fattori legati alla madre, quali le condizioni cliniche generali, il livello di viremia, il numero di CD4+, la concomitante presenza di altre malattie sessualmente trasmesse. I bambini nati da madri sieropositive nascono anch’essi sieropositivi, in quanto gli anticorpi materni che identificano la sieropositività passano nel sangue del neonato durante la gravidanza. Poi, se il bambino non ha contratto l’infezione, questi anticorpi materni pian piano vengono smaltiti, per cui il bambino “diventa” sieronegativo. Se invece il bimbo ha contratto l’infezione, allora inizia a produrre anticorpi propri e quindi “resta” sieropositivo. Altra conferma della avvenuta infezione si può avere con la determinazione della carica virale (HIV-RNA).
QUADRI CLINICI DELL’INFEZIONE DA HIV
Il decorso dell’infezione da HIV è caratterizzato da diverse fasi cliniche, la cui evoluzione è molto variabile potendo essere influenzata da svariati fattori, primo fra tutti l’impiego di una adeguata terapia antiretrovirale. Schematicamente si distinguono 5 stadi clinici, partendo dal momento del contagio fino allo sviluppo della malattia conclamata, cioè l’AIDS.
Infezione acuta primaria
Viene così definita la fase iniziale dell’infezione, rappresentata dal periodo immediatamente successivo al contagio. Nelle prime settimane di infezione gli anticorpi specifici contro l’HIV non si sono ancora formati, per cui il test per la diagnosi di sieropositività risulta negativo. Nei casi di avvenuto contagio solitamente il test diventa positivo dopo 2-3 mesi, ma ciò può accadere anche più tardivamente, per cui di solito il test viene ripetuto anche a distanza di almeno 6 mesi dall’evento a rischio. L’intervallo di tempo che va dal contagio alla positivizzazione del test viene definito “periodo finestra”, mentre la comparsa degli anticorpi viene definita sieroconversione. In questo periodo si osserva una elevata replicazione virale, che man mano si riduce in seguito alla attivazione di una specifica risposta immunitaria; per tale motivo in questa fase il soggetto risulta particolarmente infettante. Recenti studi hanno dimostrato come durante questa fase, fin dai primi giorni o addirittura dalle prime ore successive all’infezione, avviene una “lotta” tra il virus ed il sistema immunitario, il cui esito andrà ad influenzare la successiva evoluzione della malattia. L’infezione acuta decorre molto spesso in modo del tutto asintomatico, mentre a volte si può manifestare con un quadro clinico aspecifico che insorge circa 3-6 settimane dopo il contagio. In questo caso i sintomi possono essere simili a quelli di una sindrome influenzale o a quelli della mononucleosi (malattia infettiva benigna provocata dal virus di Epstein-Barr): febbre, mal di gola, malessere generale, stanchezza, sudorazioni, ingrossamento delle ghiandole linfatiche; a volte vi può essere anche un esantema tipo orticarioide. Più raramente, in alcuni pazienti si possono presentare dei quadri clinici più importanti, come per esempio una meningite a liquor limpido o manifestazioni quali la candidosi orale.
Infezione asintomatica
L’infezione da HIV è caratterizzata da un lungo periodo di latenza clinica, durante il quale non si ha alcun sintomo o segno di malattia. Durante questa fase la replicazione del virus nelle cellule del sangue è assente o molto bassa, mentre invece si mantiene sempre attiva a livello delle ghiandole linfonodali. Non si ha quindi una latenza biologica dell’infezione; infatti la persistenza di replicazione negli organi linfoidi provoca una lenta ma graduale perdita di linfociti CD4+: ogni giorno circa il 5% dell’intero comparto dei CD4+ viene distrutto dal virus, ma per lungo tempo le cellule eliminate vengono rimpiazzate pressoché integralmente. Una persona sieropositiva in questa fase non può certamente essere riconosciute come tale in base all’aspetto, come rappresentato da un poster di una campagna pubblicitaria, e se non è a conoscenza del proprio stato può inconsapevolmente trasmettere l’infezione ad altri. La durata di questa fase è molto variabile, e può essere influenzata da vari fattori, tra i quali soprattutto l’impiego di una terapia antiretrovirale. In assenza di trattamento la maggior parte dei pazienti evolve verso la malattia in un periodo medio di circa 8-10 anni; una quota minore ha una evoluzione più rapida, in circa 4-6 anni, mentre un 10-12% circa di soggetti sieropositivi hanno la tendenza a non ammalarsi anche dopo 12 anni e oltre di infezione; questi ultimi vengono definiti long term non-progressors. La spiegazione di questa lenta progressione potrebbe essere attribuita a fattori genetici che influenzano la capacità del sistema immunitario di contrastare l’infezione virale. Lo sviluppo di una sintomatologia clinica evolve parallelamente alla compromissione delle difese immunitarie, evidenziate dal calo dei linfociti CD4+, e all’aumento della replicazione virale. L’andamento di questi valori influenza in modo determinante il rischio di progressione dell’infezione.
LINFOADENOPATIA GENERALIZZATA PERSISTENTE (PGL o LAS)
Questa fase in realtà spesso non è differenziabile da un punto di vista clinico rispetto alla precedente, e non rappresenta un fattore di rischio particolare per lo sviluppo della malattia. Infatti non vi sono particolari sintomi clinici, ed il dato principale è rappresentato dall’ingrossamento dei linfonodi, che dal punto di vista strutturale presentano una alterazione della propria struttura istologica.
Complesso AIDS-correlato (ARC) Questa fase, la cui definizione viene descritta da un punto di vista clinico ma non viene solitamente utilizzata nella pratica clinica, è caratterizzata da vari sintomi clinici e da determinate alterazioni degli esami di laboratorio, Identificano il quadro di ARC anche alcune cosiddette infezioni opportunistiche minori, quali:
- Candidosi orale o oro-faringea
- Leucoplachia orale villosa
- Herpes-Zoster multidermatomerico
- Condilomatosi genitale
La fase di ARC solitamente precede la fase della malattia conclamata.
AIDS Col progredire del danno al sistema immunitario, evidenziato dalla marcata riduzione dei linfociti CD4+, l’organismo viene esposto al rischio di sviluppare determinate patologie, di tipo infettivo e neoplastico, definite opportunistiche. Le infezioni opportunistiche sono provocate da microrganismi abitualmente presenti nell’ambiente, che non sono patogeni per soggetti con integrità delle difese immunitarie ma che possono provocare malattie anche gravi in pazienti che abbiano una situazione di immunodeficienza. Si considera che il rischio di sviluppare queste infezioni sia presente quando i linfociti CD4+ sono inferiori ai 200/mmc, mentre è molto elevato per valori inferiori a 100/mmc. La fase di malattia conclamata, definita con il termine di AIDS (sindrome da immunodeficienza acquisita), inizia proprio quando compare una di queste patologie. Prima della disponibilità dei nuovi farmaci antiretrovirali (quindi prima del 1996 in Italia) la sopravvivenza media di un paziente sieropositivo dal momento della diagnosi di AIDS era di circa 10-12 mesi. Negli ultimi anni invece, grazie alle nuove possibilità terapeutiche la prognosi è radicalmente cambiata, con un miglioramento oltre che della durata anche della qualità della vita.
RISPOSTA IMMUNE NEI CONFRONTI DELL’HIV
In genere i virus, quando infettano un organismo, inducono una intensa risposta da parte del sistema immunitario, soprattutto dell’immunità cellulo-mediata, espletata prevalentemente dai linfociti killer, in grado di distruggere direttamente le cellule infette, e dai linfociti T-helper CD4+, in grado di produrre varie sostanze (citochine) dotate di attività antivirale o che hanno la capacità di stimolare altre cellule, come per esempio i linfociti B, i quali a loro volta producono gli anticorpi. L’HIV induce una risposta immune basata principalmente sulla attività dei linfociti CD4+; questa può essere indirizzata in due modi differenti, a secondo della sottoclasse di T-helper che viene maggiormente stimolata:
- risposta T-helper 1 (Th1): inducono prevalentemente l’immunità cellulo-mediata. Vengono attivati alcuni linfociti citotossici (linfociti CD8) in grado di bloccare in modo abbastanza efficace le cellule infettate dal virus; in questo caso l’infezione viene contrastata meglio e l’infezione progredisce più lentamente verso la fase di malattia;
- risposta T-helper 2 (Th2): inducono prevalentemente l’immunità umorale. Viene ridotta la produzione di linfociti CD8 mentre aumenta la produzione di anticorpi; questo tipo di risposta non è in grado di contrastare efficacemente la replicazione virale, per cui la progressione dell’infezione avviene in modo più rapido.
Si pensa quindi che lo sviluppo della malattia sia provocato da un progressivo passaggio dalla risposta Th1 alla risposta Th2.
VARIBILITA’ GENETICA L’HIV
Ha la capacità di andare facilmente incontro a variazioni della propria struttura genetica (mutazioni), che si verificano soprattutto in seguito ad errori di “copiatura” da parte della transcriptasi inversa. Queste mutazioni provocano l’insorgenza di ceppi varianti, che aiutano il virus a non essere riconosciuto, e quindi non adeguatamente combattuto, dal sistema immunitario. Le mutazioni sono inoltre responsabili dell’insorgenza di resistenza ai farmaci in corso di terapia antivirale.
IMMUDODEFICIENZA
Durante tutto il periodo di infezione c’è una continua ed incessante lotta tra il virus ed il sistema immunitario. L’HIV con l’andar del tempo è in grado di produrre un danno progressivo al sistema immunitario, che alla fine non è più in grado di svolgere efficacemente le proprie funzioni. Si verifica così una situazione di immunodeficienza, in seguito alla quale un individuo può essere infettato da microrganismi che sono solitamente innocui per chi ha una normale funzione immunitaria (infezioni opportunistiche).
La teoria finora ritenuta più valida per spiegare come l’HIV provoca il deficit immunitario è probabilmente quella ipotizzata dal Dott. David Ho. In termini semplici, Ho paragona la riduzione dei linfociti T al calo del livello di acqua in una vasca nella quale il deflusso dallo scarico sia più veloce dell’afflusso di nuova acqua dal rubinetto. In pratica Ho sostiene che i linfociti T vengano infettati e distrutti dall’HIV più velocemente di quanto il sistema immunitario sia in grado di produrne di nuovi.
Studi più recenti sembrano però dimostrare che questo meccanismo da solo non sia sufficiente a spiegare il severo grado di immunodeficienza che si verifica nei soggetti con infezione da HIV nelle fasi più avanzate della malattia.
Ricercatori della University of California hanno utilizzato una nuova tecnica di biologia molecolare per studiare in vivo la dinamica della produzione e della distribuzione dei T linfociti in pazienti HIV positivi, confrontando i risultati ottenuti con quelli riscontrati in volontari sani. La teoria che ne è emersa afferma che la causa principale dello sviluppo dell’immunodeficienza non è tanto la distruzione delle cellule T esistenti (anche se questo comunque avviene), ma piuttosto la conseguenza della incapacità da parte del sistema immunitario di produrre nuove cellule ad un ritmo adeguato. Per usare il paragone del Dr. Ho, il livello dell’acqua nella vasca diminuisce non tanto perchè aumenta la velocità dello scarico, ma soprattutto perchè si riduce la quantità di acqua che affluisce dal rubinetto.
Ci sarebbe quindi un qualche fattore che impedisce la produzione di nuove cellule in quantità adeguata. Gli Autori ipotizzano che ciò possa dipendere prevalentemente da un danno a carico degli organi dove ha sede la produzione dei T linfociti, e cioè il midollo osseo ed il timo.
DIAGNOSI Per l’identificazione dell’infezione da HIV sono disponibili varie metodiche, basate sulla identificazione degli anticorpi prodotti dal sistema immunitario contro l’HIV (metodiche sierologiche) oppure sulla ricerca di antigeni e molecole del virus stesso (metodiche virologiche).
Ai fini della diagnosi di infezione attualmente vengono utilizzati il test ELISA ed il test Western-Blot:
Test Immunoenzimatico (ELISA) E’ la metodica utilizzata per il test di screening, in quanto di facile esecuzione e di costo limitato. Questo test ricerca gli anticorpi prodotti contro alcuni antigeni virali, in particolare gp 41 e gp120, che dopo una prima infezione restano nell’organismo per tutta la vita. Il test ha una sensibilità di oltre il 95%, ma in alcuni casi si possono avere delle risposte errate:
- falsi positivi: il test risulta positivo in assenza di infezione. Può succedere in persone con malattie che alterano la funzione del sistema immunitario portando alla produzione di anticorpi anomali (es: leucemie, linfomi, malattie autoimmuni, gravi epatopatie, ecc.);
- falsi negativi: il test risulta negativo anche se l’infezione è presente. Può succedere in persone che si sono infettate molto recentemente, ma nelle quali non si sono ancora formati gli anticorpi che reagiscono con il test; questo avviene solitamente nelle prime settimane (o mesi) dopo il contagio, e questo intervallo di tempo prende il nome di periodo finestra (vedi Quadri clinici).
Per questi motivi un test negativo va sempre ripetuto fino ad almeno 6 mesi dopo un evento a rischio di contagio, ed un test positivo richiede sempre l’esecuzione di un altro test di conferma.
Western Blot (WB) E’ un test dotato di maggiore specificità e sensibilità, utilizzato per confermare la positività di un test ELISA. Questa metodica permette di evidenziare la presenza di anticorpi diretti contro le maggiori proteine virali: il test viene definito positivo quando sono presenti almeno 2 degli anticorpi principali; se il test risulta dubbio o indeterminato va ripetuto dopo alcuni mesi.
Vi sono poi metodiche basate sulla ricerca di antigeni o componenti virali, che vengono solitamente utilizzate non a fini diagnostici ma per il monitoraggio dell’andamento dell’infezione, in particolare in corso di terapia antiretrovirale:
Antigenemia p24 La proteina p24 è un antigene del core virale, e la sua presenza nel sangue indica uno stato di attiva replicazione del virus. La positività dell’antigenemia p24 è più frequente nel periodo successivo al contagio e nelle fasi più avanzate della malattia. Questo test attualmente non viene più eseguito, in quanto superato per sensibilità dalla ricerca dell’RNA virale.
Viremia (HIV-RNA) Consente di ricercare molecole di RNA virale, la cui quantità nel sangue è direttamente proporzionale al grado di attività replicativa del virus. La viremia viene espressa in numero di copie di HIV-RNA per ml; ci sono vari tipi di test che possono essere utilizzati per la determinazione della viremia:
Q-PCR (Quantitative Polymerase Chain Reaction): noto con il nome di Amplicore Monitor Test (Roche), è la metodica più diffusa, ed ha un range di sensibilità tra 300 e 1.000.000 di copie; è stato inoltre sviluppato, sempre dalla Roche, un test definito UltraSensitive, in quanto arriva a misurare fino a 20 copie/ml;
bDNA (branched-chain DNA): sviluppato dalla Chiron, ha una sensibilità che varia dalle 50 alle 500.000 copie;
NASBA (Nucleid Acid Sequence-Based Amplification): sviluppato dalla Organon Teknika, è il test solitamente meno utilizzato, ed ha una soglia inferiore di 80 copie.
Nella pratica clinica questo test viene oggi impiegato principalmente per due scopi: la stadiazione dell’infezione ed il monitoraggio della risposta alla terapia antiretrovirale. Viene anche utilizzato per la diagnosi precoce di infezione in particolari situazioni, quali le esposizioni accidentali negli operatori sanitari e la trasmissione materno-fetale.
ISOLAMENTO VIRALE
E’ la metodica più importante per dimostrare la presenza di una infezione virale, ma nella pratica clinica non viene utilizzata a causa del costo elevato e delle difficoltà operative che richiedono la presenza di un laboratorio molto specializzato. L’isolamento virale oggi viene impiegato essenzialmente a fini di ricerca
TERAPIA
Negli ultimi due anni sono stati fatti notevoli ed entusiasmanti passi avanti nella terapia dell’infezione da HIV. Ciò che ha reso possibile questo miglioramento può essere riassunto nei seguenti punti:
- una migliore comprensione della patogenesi dei danni prodotti dall’HIV;
- la possibilità di determinare la carica virale, e di avere così un parametro diretto della effettiva replicazione virale;
- la disponibilità di nuovi farmaci con una potente attività antiretrovirale;
- la comprensione della necessità di utilizzare combinazioni terapeutiche con più farmaci contemporaneamente.
La Conferenza Mondiale sull’infezione da HIV tenutasi a Vancouver, Canada, nel 1996, è diventata una pietra miliare nella storia della malattia, in quanto per la prima volta vennero mostrati i risultati delle nuove combinazioni terapeutiche, e per la prima volta si arrivò ad ipotizzare la possibilità di eradicare l’infezione. Il motto coniato dal Dott. David Ho, “Hit Early, Hit Hard”, cioè “Colpisci presto, colpisci forte”, ha modificato radicalmente l’atteggiamento terapeutico nei confronti dell’infezione, portando ad iniziare la terapia più precocemente di quanto non venisse fatto in passato. Il razionale di questa strategia consiste nell’iniziare il prima possibile la terapia in modo da bloccare la replicazione virale quando il sistema immunitario è ancora efficiente e quindi in grado di recuperare pienamente le sue funzioni, e prima che insorgano mutazioni nella popolazione virale in grado di indurre resistenza alla terapia stessa.
Nella pratica clinica questa teoria si scontra con altri aspetti:
- la difficile tollerabilità dei farmaci, i quali possono provocare effetti collaterali che ne richiedono la sospensione e che richiedono un impegno notevole da parte del paziente per rispettare le dosi e le modalità di assunzione;
- la possibile insorgenza di resistenze, in grado di rendere inefficace l’azione dei farmaci;
- la difficile penetrazione dei farmaci in vari distretti dell’organismo, i cosidetti santuari, nei quali pertanto il virus non può essere aggredito.
Per tali motivi oggi si ritiene che l’eradicazione dell’infezione non sia realizzabile con gli strumenti attualmente a disposizione, mentre si pensa che un obiettivo raggiungibile possa essere quello di cronicizzare l’infezione, cioè di arrestarne l’evoluzione a tempo indeterminato.
In Italia vi sono circa 10 farmaci antiretrovirali appartenenti a tre diverse classi farmacologiche, ognuna con un diverso meccanismo d’azione. Tutti questi farmaci non sono in grado di uccidere il virus, ma agiscono bloccandone la replicazione. Tali farmaci pertanto non sono attualmente curativi, ed i pazienti in trattamento, anche se hanno una carica virale non rilevabile nel sangue, devono comunque ritenersi sempre potenzialmente infettanti.
Inibitori Nucleosidici della Transcriptasi Inversa (RTI) I farmaci appartenenti a questa classe sono stati i primi ad essere utilizzati nella terapia dell’infezione da HIV; il capostipite di questi infatti, la Zidovudina (AZT), e’ stata utilizzata fin dal 1987. I risultati che si ottenevano erano però solo transitori, e questo era dovuto al fatto che il suo impiego in monoterapia provocava rapidamente l’insorgenza di resistenze.
Meccanismo d’azione : questi farmaci sono in grado di inibire il processo di replicazione del virus mediante il blocco della trascrizione dell’RNA virale in DNA provirale ; agiscono sostituendosi alle basi azotate durante la trascrizione, in modo che il DNA provirale neoformato sia incompleto e quindi incapace di originare nuove particelle virali.
Inibitori Non-Nucleosidici della Transcriptasi Inversa (NNRTI)
Inibitori delle Proteasi (IP) Sono i farmaci che hanno radicalmente modificato l’impatto della terapia antiretrovirale, essendo caratterizzati da una potente attivita’ di blocco della replicazione virale.
Il motivo principale dell’insuccesso di una terapia è dovuto alla insorgenza di resistenza ai farmaci; ciò succede quando il virus va incontro a delle mutazioni della propria struttura genetica che gli permettono di “sfuggire” all’azione del farmaco. Poiché le mutazioni compaiono durante la replicazione, è evidente che la loro insorgenza è la diretta conseguenza di una incompleta soppressione dell’attività virale, quale si verifica per esempio in caso di assunzione scorretta della terapia o di inadeguatezza della stessa. Per ridurre il rischio che ciò accada sono essenziali due fattori:
- utilizzare più farmaci in combinazione fra loro;
- ottimizzare l’aderenza del paziente alla terapia.
Terapia con più farmaci L’impiego di una terapia di combinazione con farmaci diversi consente di aggredire il virus da più parti, riducendo così la possibilità che questo possa andare incontro a mutazioni e quindi a sviluppare resistenza . Vari studi hanno evidenziato la diversa efficacia clinica e virologica della monoterapia comparata con l’impiego di almeno 2 o 3 farmaci. Il primo studio che ha mostrato la superiorità della triplice terapia è stato l’ACTG 320; questo studio ha dimostrato che la combinazione AZT-3TC-IDV è molto più efficace dei soli AZT-3TC nel sopprimere la replicazione virale, anche in pazienti in fase avanzata di infezione.
ADERENZA AL TRATTAMENTO
Dipende da vari fattori:
- compliance: gli schemi terapeutici della terapia combinata richiedono l’assunzione di numerose compresse al giorno (anche più di 15!), ma soprattutto richiedono una particolare attenzione alle modalità di somministrazione; infatti ogni farmaco va preso ad orari fissi stando attenti a non saltare le dosi, ed inoltre alcuni vanno presi a stomaco pieno ed altri a digiuno.
- durata: la terapia va proseguita a tempo indeterminato, per cui il paziente in trattamento con antiretrovirali deve considerarsi come un malato cronico che deve assumere costantemente i farmaci per prolungare la sopravvivenza. L’interruzione della terapia comporta infatti invariabilmente la ripresa della replicazione virale e quindi della progressione dell’infezione.
- tossicità: l’ostacolo principale all’aderenza alla terapia per periodi prolungati è comunque rappresentato dalla tossicità dei farmaci, i quali possono provocare vari effetti collaterali che possono obbligare alla sospensione del trattamento, anche in presenza di un beneficio clinico. In tal caso va tenuta presente una regola generale: in caso di intolleranza o di tossicità è sempre meglio sospendere del tutto la terapia piuttosto che assumere i farmaci a dosaggio ridotto. Ciò infatti, per quanto già visto in precedenza, potrebbe favorire l’insorgenza di resistenze.
TEST DI RESISTENZA
Il problema delle resistenze ai farmaci è pertanto il principale motivo di insuccesso di una terapia antiretrovirale. In pazienti che abbiano fallito una terapia sarebbe perciò importante poter avere la possibilità di determinare in modo esatto a quali farmaci il virus è diventato resistente.